Положение металлов в периодической системе
Положение металлов в периодической системе. Металлическая связь. Физические свойства
В периодической системе более 3/4 мест занимают металлы: они находятся в I, II, III группах, в побочных подгруппах всех групп.
Кроме того, металлами являются наиболее тяжелые элементы IV, V, VI и VII групп.
Надо отметить, однако, что многие металлы обладают амфотерными свойствами и иногда могут вести себя как неметаллы.
Особенностью строения атомов металлов является небольшое количество электронов на внешнем электронном слое, не превышающее трех.

Металлы
Атомы металлов имеют, как правило, большие атомные радиусы. В периодах наибольшие атомные радиусы у щелочных металлов.
Отсюда их наиболее высокая химическая активность, т. е. атомы металлов легко отдают электроны, — являются хорошими восстановителями.
Лучшие восстановители — металлы I и II групп главных подгрупп.
В соединениях металлы проявляют всегда положительную степень окисления, обычно от +1 до +4.
В соединениях с неметаллами типичные металлы образуют химическую связь ионного характера. В виде простого вещества атомы металлов связаны между собой так называемой металлической связью.
• Запишите в тетрадь этот термин.
Металлическая связь
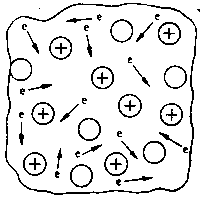
Это особый вид связи, присущий исключительно металлам. Сущность ее в том, что от атомов металлов постоянно отрываются электроны, которые перемещаются по всей массе куска металла (рис. 2).
Атомы металла, лишенные электронов, превращаются в положительные ионы, которые стремятся снова притянуть к себе свободно движущиеся электроны. Одновременно другие атомы металла отдают электроны.
Таким образом, внутри куска металла постоянно циркулирует так называемый электронный газ, который прочно связывает между собой все атомы металла.
Электроны оказываются как бы обобществленными одновременно всеми атомами металла. Такой особый тип химической связи между атомами металлов обусловливает как физические, так и химические свойства металлов.
■ 1.Чем объяснить малую электроотрицательность металлов?
2. Как возникает металлическая связь?
3. В чем отличие металлической связи от ковалентной?
Физические свойства металлов
Металлы обладают рядом сходных физических свойств, отличающих их от неметаллов. Чем больше валентных электронов имеет металл, тем прочнее металлическая связь, тем прочнее кристаллическая решетка, тем прочнее и тверже металл, тем выше его температура плавления и кипения и т. д.
Ниже рассматриваются особенности физических свойств металлов.
Все они обладают более или менее ярко выраженным блеском, который принято называть металлическим.
Металлический блеск
Металлический блеск характерен для куска металла в целом. В порошке металлы темного цвета, за исключением магния и алюминия, которые сохраняют серебристо-белый цвет, в связи с чем алюминиевая пыль используется для изготовления краски «под серебро».
Многие неметаллы обладают жирным или стеклянным блеском.
Цвет металлов
Цвет металлов довольно однообразен: он либо серебристо-белый (алюминий, серебро, никель), либо серебристо-серый (железо, свинец).
Только золото желтого цвета, а медь — красного. Неметаллы имеют весьма разнообразную окраску: сера — лимонно-желтая, бром — красно-бурый, фосфор — красный или белый, углерод — черный.
Таким образом, по цвету металлы условно делят на черные и цветные. К черным металлам относятся железо и его сплавы. Все остальные металлы называются цветными.
Металлы твердые вещества
При обычных условиях металлы представляют собой твердые вещества с кристаллической структурой .
Среди неметаллов встречаются как твердые (сера, фосфор, углерод), так и жидкие (бром) и газообразные (водород, кислород, азот) вещества.
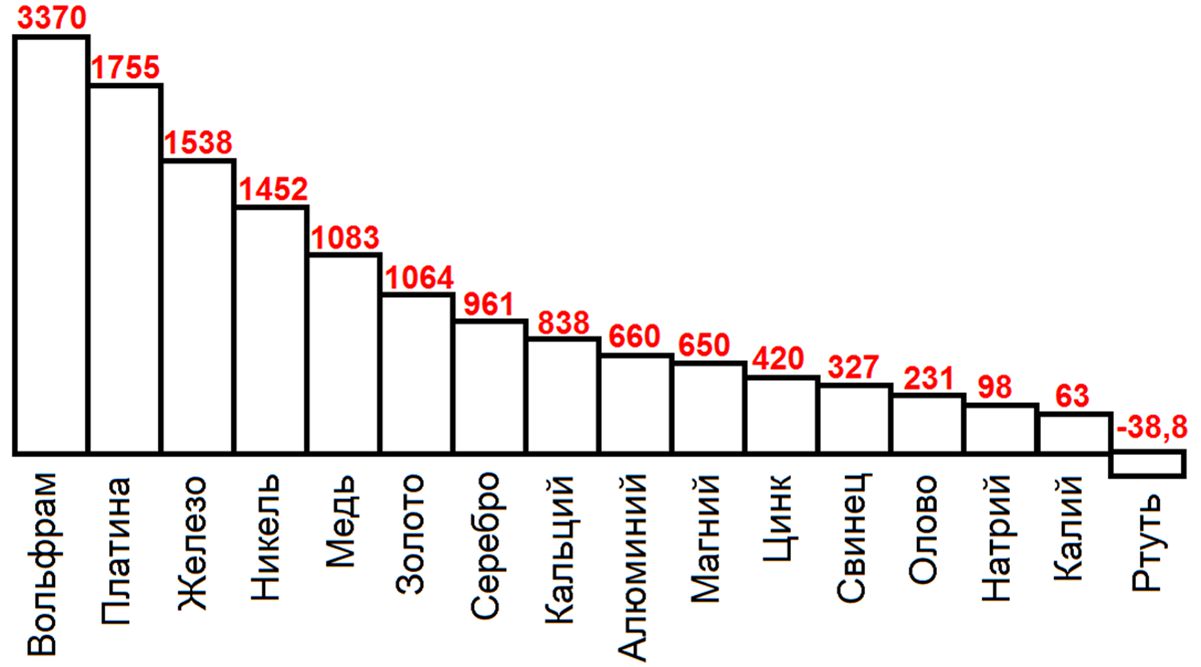
Все металлы, за исключением ртути, — твердые вещества, поэтому температура плавления их выше нуля, только температура плавления ртути —39°.
Наиболее тугоплавким металлом является вольфрам, температура плавления которого 3370°. Температура плавления остальных металлов лежит в этих пределах (рис. 3).
Температуры плавления неметаллов значительно ниже, чем металлов, например кислорода —219°, водорода —259,4°, фтора —218°, хлора —101°, брома —5,7°.
Металлы обладают различной твердостью, которую сопоставляют с твердостью алмаза . Показатель твердости металла определяют специальным прибором — твердомером.
При этом в массу металла вдавливают стальной шарик или, в случае большей твердости металла, алмазный конус.

По силе давления и глубине образовавшейся лунки определяют твердость металла.
Наиболее твердым металлом является хром. Мягкие металлы — натрий, калий — легко режутся ножом. Твердость отдельных металлов по общепринятой десятибалльной шкале,твердости представлена на рис. 4.
Пластичность ковкость
Металлы в большей или меньшей степени обладают пластичностью (ковкостью). У неметаллов это свойство отсутствует. Наиболее ковким металлом является золото.
Из него можно выковать золотую фольгу толщиной 0,0001 мм — в 500 раз тоньше человеческого волоса. В то же время сурьма весьма хрупка; ее можно даже растереть в ступке в порошок.
Пластичностью называют способность к сильной деформации без нарушения механической прочности.
Пластичность металлов используется при их прокатке, когда огромные раскаленные металлические болванки пропускают между обжимными валами, приготовляя из них листы, при волочении.
Когда из них вытягивают проволоку, при прессовании, штамповке, когда под действием давления нагретому металлу придают определенную форму, которую он сохраняет при охлаждении.
Пластичность зависит от структуры кристаллической решетки металлов .

Все металлы нерастворимы в воде, но зато растворимы друг в друге в расплавах. Твердый раствор одного металла в другом называется сплавом.
По плотности металлы разделяются на тяжелые и легкие. Тяжелыми считают те, плотность которых больше 3 г/см 3 (рис. 5).
Самым тяжелым металлом является осмий. Наиболее легкие металлы — литий, натрий, калий.— имеют плотность даже меньше единицы.
Большое применение в промышленности получили легкие металлы — магний и алюминий.
Электро- и теплопроводность
Металлы характеризуются высокой электро- и теплопроводностью (рис. 6), тогда как неметаллы обладают этими свойствами в слабой степени.
Наибольшей электро-и теплопроводностью обладает серебро, на втором месте стоит медь. Довольно высоки эти свойства у алюминия.
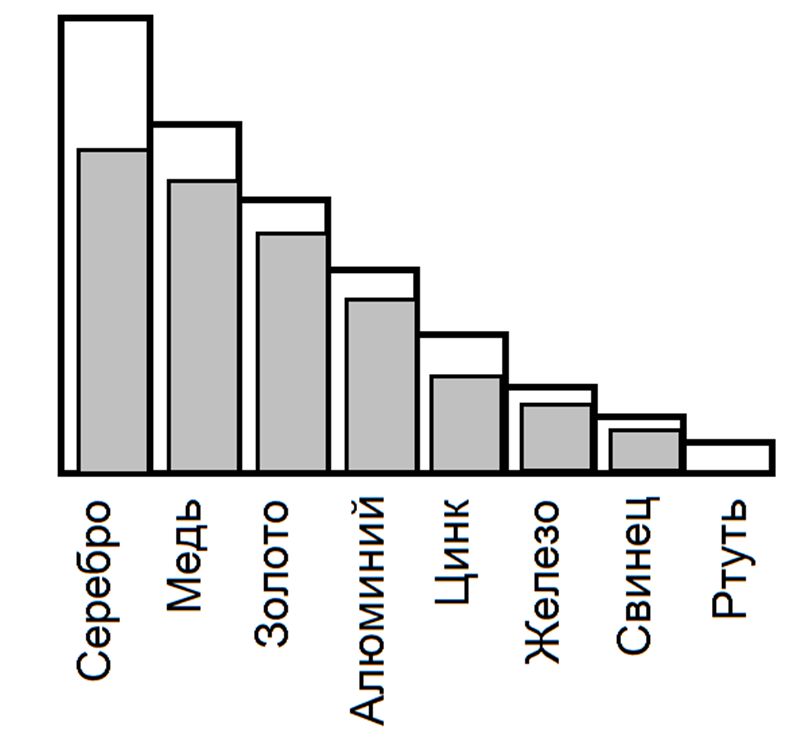
Следует отметить, что металлы с высокой электропроводностью имеют и высокую теплопроводность.
Магнитные свойства металлов
Металлы проявляют магнитные свойства. Если при соприкосновении с магнитом металл притягивается к нему и после этого сам становится магнитом, то мы говорим, что металл намагничивается.
Хорошо намагничиваются железо, кобальт, никель и их сплавы. Такие металлы и сплавы называют ферромагнитными. Неметаллы магнитными свойствами не обладают.
■ 4. Составьте и заполните следующую таблицу:
Химические свойства металлов. Коррозия
Химические и физические свойства металлов определяются атомной структурой и особенностями металлической связи. Все металлы отличаются способностью легко отдавать валентные электроны.
В связи с этим они проявляют ярко выраженные восстановительные свойства. Степень восстановительной активности металлов отражает электрохимический ряд напряжений.
Зная положение металла в этом ряду, можно сделать вывод о сравнительной величине энергии, затрачиваемой на отрыв от атома валентных электронов.
Чем ближе к началу ряда, тем легче окисляется металл.
Наиболее активные металлы вытесняют водород из воды при обычных условиях с образованием щелочи:
Менее активные металлы вытесняют водород из воды в виде перегретого пара и образуют окислы
реагируют с разбавленными и бескислородными кислотами, вытесняя из них водород:
Металлы, стоящие после водорода, не могут вытеснять его из воды и из кислот, а вступают с кислотами в окислительно-восстановительные реакции без вытеснения водорода:
Все предшествующие металлы вытесняют последующие из их солей:
Во всех случаях вступающие в реакции металлы окисляются. Окисление металлов наблюдается и при непосредственном взаимодействии металлов с неметаллами:
Большинство металлов активно реагируют с кислородом, образуя разного состава окислы.
■ 5. Как можно охарактеризовать восстановительную активность металла, пользуясь рядом напряжений?
6. Приведите примеры металлов, реагирующих с водой по типу натрия, железа. Подтвердите свой ответ уравнениями реакций.
7. Сравните взаимодействие с водой активных металлов и активных неметаллов.
8. Перечислите химические свойства металлов, подтверждая свой ответ уравнениями реакций.
9. С какими из перечисленных ниже веществ будет реагировать железо: а) кислород, б) гашеная известь, в) карбонат меди, г) соляная кислота, д) сульфат цинка, е) нитрат серебра?
10. Какой газ и в каком объеме может быть получен при действии на 5 кг смеси меди и окиси меди концентрированной азотной кислотой, если окиси меди в смеси 20%?
Что такое коррозия металла
Окисление металлов часто приводит к их разрушению. Разрушение металлов под действием окружающей среды называется коррозией.
• Запишите в тетрадь определение коррозии.
Коррозия металлов происходит под влиянием кислорода, влаги и углекислоты, а также окислов азота и пр.
Коррозия, вызванная непосредственным взаимодействием металла с веществом окружающей его среды, называется химической, или газовой, коррозией.
Например , на химических производствах металл иногда контактирует с кислородом, хлором, окислами азота и т. д., в результате чего образуются соли и окислы металла:
Кроме газовой, или химической, коррозии, существует еще электрохимическая коррозия, которая встречается гораздо чаще.
Для того чтобы понять схему электрохимической коррозии, рассмотрим гальваническую пару цинк — медь.
Возьмем цинковую и медную пластинки и опустим их в раствор серной кислоты, которая, как нам известно, содержится в растворе в виде ионов:
Соединив цинковую и медную пластинки через гальванометр, мы обнаружим наличие в цепи электрического тока.
Это объясняется тем, что атомы цинка, отдавая электроны, в виде ионов переходят в раствор:
Zn 0 — 2е — → Zn +2
Электроны через проводник переходят на медь, а с меди — на ионы водорода:
Водород в виде нейтральных атомов выделяется на медной пластинке, а цинк постепенно растворяется.
Таким образом, медь, как бы оттягивая электроны с цинка, заставляет последний быстрее растворяться, т. е. способствует окислению.
В то же время совершенно чистый цинк может некоторое время находиться в кислоте, совершенно не подвергаясь ее действию.

По такой же схеме происходит коррозия такого металла, как железо, только электролитом на воздухе является угольная кислота, а примеси к железу играют роль второго электрода гальванической пары.
Эти пары микроскопические, поэтому разрушение металла идет гораздо медленнее.
Разрушению обычно подвергается более активный металл.
Таким образом, электрохимическая коррозия — это окисление металла, сопровождающееся возникновением гальванических пар.
Коррозия металлов причиняет большой ущерб народному хозяйству.
12. Дайте определение коррозии.
11. Можно ли считать коррозией то, что натрий на воздухе быстро окисляется, взаимодействие цинка с соляной кислотой, взаимодействие алюминия с окисью железа при термитной сварке, получение водорода при взаимодействии железа с перегретым водяным паром.
13. Какая разница между химической и электрохимической коррозией?
Защита металлов от коррозии
Для борьбы с коррозией существует много способов. Металлы (в частности, железо) покрывают масляной краской, образующей на поверхности металла плотную пленку, не пропускающую кислород и пары воды.
Можно покрывать металлы, например медную проволоку, лаком, который одновременно защищает металл от коррозии и служит изолятором.
Воронение
Воронение — это процесс, при котором железо подвергают действию сильных окислителей, в результате чего металл покрывается не проницаемой для газов пленкой окислов, предохраняющей его от воздействия внешней среды.
Чаще всего это бывает магнитная окись Fe3О4, которая глубоко внедряется в слой металла и защищает его от окисления лучше всякой краски.
Уральское кровельное железо, подвергнутое воронению, продержалось на кровле без ржавления более 100 лет.
Чем лучше отполирован металл, тем плотнее и прочнее образованная на его поверхности пленка окислов.
Эмалирование
Эмалирование — очень хороший вид защиты от коррозии различной посуды. Эмаль не поддается не только действию кислорода и воды, но даже сильных кислот и щелочей.
К сожалению, эмаль весьма хрупка и при ударе и быстрой смене температур довольно легко трескается.
Очень интересными способами защиты металлов от коррозии являются цинкование, а также никелирование и лужение.
Цинкование
Цинкование — это покрытие металла слоем цинка (так защищают главным образом железо).
При таком покрытии в случае нарушения поверхностной пленки цинка коррозии подвергается сначала цинк как более активный металл, но цинк хорошо сопротивляется коррозии, так как его поверхность покрыта не проницаемой для воды и кислорода защитной пленкой окиси.
Никелирование
При никелировании (покрытии никелем) и лужении (покрытии оловом) ржавление железа не происходит до тех пор, пока не нарушен слой покрывающего его металла.
Как только он нарушается, начинается коррозия железа как наиболее активного металла. Но никель — металл, сравнительно мало подвергающийся коррозии, поэтому его пленка держится на поверхности очень долго.
Лудят чаще всего медные предметы, и тогда гальваническая пара медь — олово всегда приводит к коррозии олова, а не меди, которая менее активна как металл.
При лужении железа получают «белую жесть» для консервной промышленности.
Что такое ингибиторы коррозии металла
Для защита oт коррозии можно воздействовать не только на металл, но и на среду, которая его окружает.
Если к соляной кислоте примешать некоторое количество хромата натрия, то реакция соляной кислоты с железом настолько замедлится, что практически кислоту можно перевозить в железных цистернах, тогда, как обычно это невозможно.
Вещества, замедляющие коррозию, а иногда и практически полностью останавливающие ее, называются ингибиторами — замедлителями (от латинского слова inhibere — тормозить).
Характер действия ингибиторов различен. Они либо создают на поверхности металлов защитную пленку, либо уменьшают агрессивность среды.
К первому типу относятся, например , нитрит натрия NaNО2, замедляющий коррозию стали в воде и растворах солей, хроматы, замедляющие коррозию алюминия в серной кислоте.
Ко второму — органическое соединение CO(NH2)2 — мочевина, которая очень замедляет растворение в азотной кислоте меди и других металлов.
Ингибиторными свойствами обладают животные белки, углеводы, некоторые высушенные растения — чистотел, лютик и т. д.
Иногда, чтобы усилить устойчивость металла к коррозии, а также придать ему некоторые более ценные свойства, из него изготовляют сплавы с другими металлами.
■ 14. Запишите в тетрадь перечисленные способы защиты металла от коррозии.
15. Чем определяется выбор способа защиты металла от коррозии?
16. Что такое ингибитор? Чем ингибитор отличается от катализатора?
Способы выплавки металлов из руд
Металлы в природе могут встречаться в самородном состоянии. Это в основном благородные металлы, например золото.
Его извлекают путем механической отмывки от окружающих пород. Однако подавляющее большинство металлов встречается в природе в виде соединений.
Вместе с тем не всякий природный минерал годится для получения содержащегося в нем металла. Следовательно, не всякий минерал можно назвать металлической рудой.
Горная порода или минерал, содержащие тот или иной металл в количестве, которое делает экономически выгодным его промышленное получение, называются рудами данного металла.
• Запишите определение руд.
Из руд металлы получаются различными способами.
1. Если руда представляет собой окисел, то ее восстанавливают каким-либо восстановителем — чаще всего углеродом или окисью углерода СО, реже — водородом, например :
2. Если руда представляет собой сернистое соединение, то ее сначала обжигают:
затем полученный окисел восстанавливают углем:
РbО + С = РbО + CO
Из хлоридов металлы выделяют электролизом из расплавов. Например , при плавлении поваренной соли NaCl происходит термическая диссоциация вещества.
При пропускании постоянного электрического тока через этот расплав идут следующие процессы:
Этим способом можно получить металлы и из других солей.
4. Иногда металлы можно восстановить из окислов путем вытеснения при высокой температуре другим, более активным металлом. Этот способ получил особенно широкое распространение при восстановлении металлов алюминием и потому сначала был назван алюминотермией:
Во многих случаях руда может оказаться смешанной с большим количеством пустой породы, для удаления которой, т. е. для «обогащения» руды, существуют различные методы, в частности метод пенной флотации.
Для этой цели применяются минеральные масла, обладающие свойством избирательной адсорбции. Это значит, что частицы руды они поглощают, а пустую породу нет.
В огромные чаны с водой помещают измельченную вместе с пустой породой руду и минеральное масло.
После этого воду сильно вспенивают воздухом. Масло окружает пузырьки воздуха, образуя на них пленку. Получается устойчивая пена.
Частицы, руды адсорбируются и вместе с пузырьками воздуха поднимаются наверх. Пена вместе с рудой сливается, а пустая порода остается на дне чана.
В дальнейшем руду легко освобождают от масла, которое снова используется для флотации.
■ 17. Что такое пенная флотация?
18. Какими свойствами должен обладать металл, чтобы находиться в природе в самородном состоянии?
19. Можно ли назвать рудой любой минерал или горную породу, содержащую в своем составе тот или иной металл?
20. Перечислите, какие виды металлических руд вам известны.
21. Цинк встречается в природе в виде минерала цинковой обманки, содержащей сульфид цинка. Предложите способ получения цинка из цинковой обманки.
22. Из 2 т магнитного железняка, содержащего 80% магнитной окиси железа Fe3O4 получено 1,008 т железа. Рассчитайте практический выход железа.
23. Какие металлы могут быть получены электролизом растворов солей?
24. Из железа, полученного при восстановлении 5 т магнитного железняка, содержащего 13% примесей, приготовили сплав, содержащий 4% углерода. Сколько сплава при этом удалось получить?
25. Какое количество цинка и серной кислоты можно получить из 242,5 т цинковой обманки ZnS, содержащей 20% пустой породы? (См. Ответ)
Статья на тему Положение металлов в периодической системе
Похожие страницы:
Коррозия металлов и защита металлов от коррозии [no_toc] Коррозия металлов это химический процесс разрушения, под воздействием окружающей среды который может.
Химические свойства металлов Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно.
ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ [no_toc] Приступая к изучению все о металлах в химии мы остановимся вначале на общих свойствах металлов и.
Коррозия металлов это необратимый процесс окисления поверхности металлов, которая происходит от химического взаимодействия например железа с водой. Процессы коррозии могут.
Ряд активности металлов это последовательность в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов. Металлы в ряду активности.
Автоклавное восстановление металлов из растворов водородом и другими газами Восстановлению обязательно должно предшествовать образование водородного электрода, возможное при контакте газа.
https://znaesh-kak.com/x/s/%D0%BF%D0%BE%D0%BB%D0%BE%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D0%BE%D0%B2